Oxidul de hidrogen, APA, H2O
Stare naturala
1. Atmosfera contine vapori de apa in concentratii ce variaza cu temperatura si presiunea. Acestia provin in majoritate din evaporarea marilor si oceanelor si, in mica parte, din evaporarea ghetarilor. Vaporii de apa din atmosfera se condenseaza sub forma de nori, ceata, ploaie, grindina sau zapada, cand este atinsa pesiunea de saturatie la temperatura respective si sub forma de roua, bruma sau chiciura, cand condensarea apei are loc heterogen, pe suprafete reci (apa meteorica).
2. Hidrosfera. Din suprafata totala (de 5,1 * 108 km2) a globului pamantesc 71% (sau 3,62 * 108 km2) este ocupata de mari si oceane. Din suprafata uscatului (1,48 *108 km2), putin mai mult de 10% (1,58 * 107 km2) este acoperita cu ghetari.
Volumul marilor si oceanelor este evaluat la 1,37 * 109 km3 (cca. 1/800 din volumul planetei). Volumul ghetarilor din regiunea arctica si antarctica este apreciat la 2,9 * 107 km3. La polul sud grosimea ghetii este de 2700 m, iar in punctul cel mai adanc al continentului antarctic atinge 4200 m. S-a sapat acolo, intr-un loc, o sonda pana la roca de baza la 2187 m, gasindu-se la fund apa lichida. Daca toti ghetarii s-ar topi, nivelul oceanelor s-ar ridica cu cca. 80 m.
Prin cantitatea mare de apa din straturile sale exterioare pamantul se deosebeste fundamental de celelalte planete, care sunt sarace in apa sau lipsite de apa.
Apa oceanelor contine in medie 35 g saruri la litru (din care 27 g sunt NaCl).
Marile interioare au concentratii fie mai mari (Marea Mediterana), fie mai mici
(Marea Neagra) decat apa oceanelor. Metalele sunt continute in apa de mare sub
forma de cationi (Na+, Mg2+, Ca2+ etc.)
halogenii sub forma de anioni (Cl , Br etc.),
sulful ca ioni de sulfat (![]() ), iar carbonul sub forma de CO2 si de ioni de
carbonat acid (
), iar carbonul sub forma de CO2 si de ioni de
carbonat acid (![]() ).
).
3. Apa izvoarelor si a raurilor. Apa meteorica, o data ajunsa pe pamant, poate strabate prin straturi permeabile (humus, nisip) pana ajunge la o patura impermeabila (argila), deasupra careia formeaza o panza de apa subterana (apa freatica). Apa subterana reapare, la suprafata, in izvoare, sau este extrasa prin fantani, puturi sau sonde.
Compozitia chimica a acestei ape variaza cu natura rocilor cu care a fost in contact. Cel mai scazut continut in substante minerale dizolvate il are apa izvoarelor de munte (cca. 50 mg materii solide la litru) si aceea provenita din topirea ghetarilor. Apele freatice au de obicei un continut mai mare in substante minerale (normal cca. 2 g/l), iar in apele raurilor se mai gasesc si substante minerale suspendate si materii organice.
Apa izvoarelor si a raurilor contine, dizolvate gazele din aer: oxigen, azot si bioxid de carbon; cationi: calciu, magneziu si sodiu si anioni de bicarbonat, sulfat si clorura. O apa cu un continut mare de bicarbonat de calciu, o apa dura, nu face spuma cu sapunul si depune carbonat de calciu la fierbere (formarea de cruste in cazanele de aburi). O apa subterana bogata in bicarbonat de calciu degaja, cand iese la aer, CO2 si depune carbonat de calciu (formarea stalactitelor; despre echilibrul: carbonat →← bicarbonat de calciu.
Apa raurilor este din ce in ce mai mult poluata cu deseuri industriale. Acestea au o influenta nociva asupra animalelor si plantelor acvatice. Purificarea apelor reziduale industriale este una din problemele importante ale vremurilor noastre.
4. Ape minerale. Multe izvoare au prilejul sa dizolve din straturile scoartei pamantului cu care vin in contact, substante solide sau gazoase, in cantitati anormal de mari, sau substante neobisnuite. Se disting urmatoarele categorii de ape minerale: izvoare acide simple, cu un continut mare de CO2 si putine substante minerale; izvoare carbonice, cu CO2 si bicarbonati de sodiu, calciu si magneziu; izvoare alcaline, continand mult bicarbonat si putin CO2; izvoare sarate, cu un continut de peste 15 g/l NaCl; izvoare amare, continand sulfati de sodiu si magneziu; izvoare sulfuroase, continand sulfuri alcaline si H2S liber; izvoare iodurate, continand I si izvoare arsenicale, continand, trioxid de arsen sau arseniti.
5. Apa pura se obtine din apa obisnuita, prin distilare, eventual repetata, in conditii in care sa nu poata dizolva gaze din aer sau substante solide din recipientele in care este consevata (de ex. alcalii din sticla obisnuita). Echivalenta cu o apa bine distilata este apa deionizata cu schimbatori de ioni.
Proprietati fizice
1. Diferite proprietati fizice ale apei servesc pentru definirea unor marimi fizice fundamentale. Dupa cum se stie, temperaturile de topire si de fierbere ale apei, la presiunea de 760 torr, definesc unitatea de temperatura in scara Celsius si implicit in scara temperaturilor absolute. Unitatea de masura pentru caldura, caloria, este egala cu capacitatea calorica a unui gram de apa (la 15oC). Unitatea de masa, kilogramul, este egala (aproximativ) cu masa unui decimetru cub de apa pura, la temperatura densitatii maxime (4oC).
2. Punctele de topire si de fierbere ale apei au valori anormal de ridicate, comparativ cu hidrurile elementelor vecine din sistemul periodic. Apa este un lichid la temperatura obisnuita, in timp ce hidrurile elementelor vecine sunt gazoase:
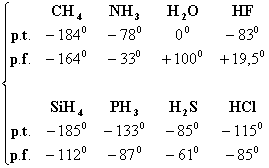
Anomalii ale punctelor de topire si de fierbere, similare cu cele observate la apa, dar mai putin pronuntate, se intalnesc si la cele doua hidruri vecine cu apa: acidul fluorhidric si amoniacul, in timp ce metanul, precum si hidrurile elementelor din perioadele 3, 4 si 5, cum sunt H2S, HCl etc., nu prezinta urcari anormale ale punctelor de fierbere.
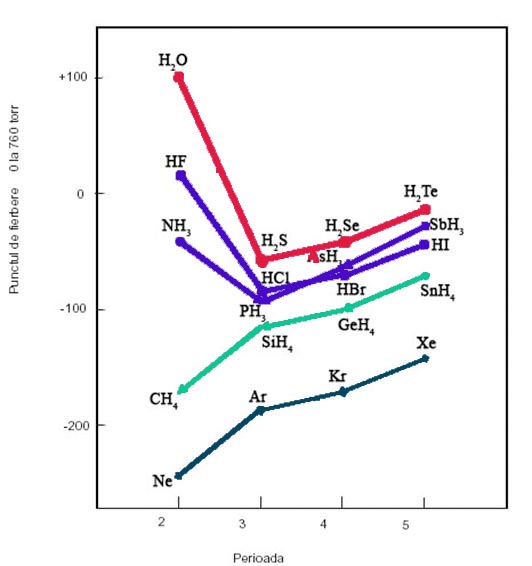
Figura 1: Puncte de fierbere ale unor hidruri moleculare si gaze rare
3. Densitatea. Curba variatiei densitatii apei cu temperatura nu descreste monoton, ca la celelalte lichide, ci intai creste, de la 00 la 40C, apoi scade:
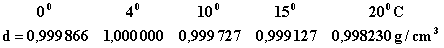
Gheata de 00 are densitatea 0,91 g/cm3. La inghetarea apei are deci loc o scadere brusca a densitatii, respectiv a cresterii volumului, cu aproape 10 %.
Anomalia densitatii apei explica unele proprietati mecanice unice ale apei, diferite de ale tuturor celorlalte substante.
Punctul de solidificare al apei (00 la 760 torr) scade cand se mareste presiunea. Conform principiului lui Le Chatelier, marirea presiunii deplaseaza echilibrul gheata apa, inspre forma cu volum mai mic (si densitate mai mare) deci spre apa. Asa se explica alunecarea patinei si a saniei pe gheata. La un lichid normal (compus din molecule unite prin forte van der Waals) forma cea mai compacta este cea cristalina. Marirea presiunii stabilizeaza, in acest caz forma cristalizata, ridica deci punctul de topire. Pe un asemenea solid nu s-ar putea patina.
Anomaliile densitatii apei au o mare influenta asupra climei planetei si asupra vietii animalelor si plantelor. Apa de 40C, Avand densitatea mai mare decat apa mai calda sau mai rece, se aduna la fundul marilor si oceanelor. Acestea au, sub adancimea de cca. 1000 m, temperatura de 40C, iar sub cca. 3000 m, 30C. Din cauza acestui fenomen, apele mai adanci nu ingheata pana la fund, ceea ce ar face viata imposibila.
4. Alte anomalii. a. Caldura de vaporizare a apei este anormal de mare, dupa cum reiese din compararea cu calduri de vaporizare ale hidrurilor vecine din sistemul periodic, precum si din abaterile de la regula lui Trouton.
b. Capacitatea calorica (caldura specifica) a apei este anormal de mare, comparativ cu ale altor hidruri covalente.
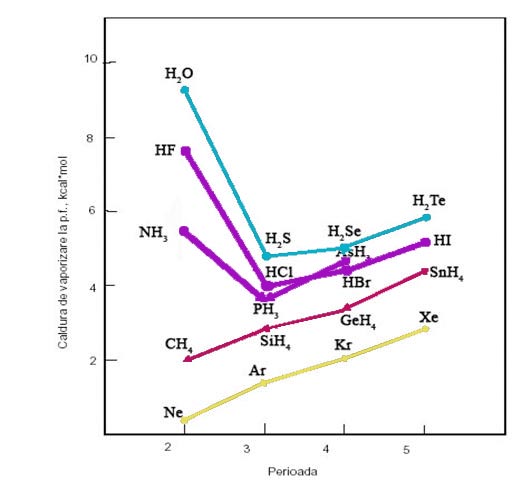 |
Figura 2: Calduri de vaporizare la punctele de fierbere ale unor hidruri moleculare si gaze rare
c. Tensiunea superficiala a apei este considerabil mai mare decat a celorlalte lichide.
Aceste anomalii ale proprietatilor fizice ale apei se datoresc asociatiei moleculelor H2O, prin legaturi de hidrogen.
Structura ghetii si a apei
1. Structura moleculei H2O. In stare de vapori, apa este compusa din molecule H2O, neasociate (masa moleculara, M = 18). Molecula H2O are o structura angulara, cu cele doua distante HO egale, de 0,96 Ǻ si unghiul de valenta de 104,50.
2. Structura ghetii. In reteaua cristalina a ghetii obisnuite, asa cum a fost determinata prin difractia razelor X, fiecare molecula de apa este inconjurata de alte patru molecule, asa incat atomii O ai celor patru molecule sa formeze un tetraedru. Fiecare atom H al moleculei centrale formeaza o legatura de hidrogen cu cate o pereche de electroni neparticipanti ai altor doua molecule H2O si fiecare pereche de electroni neparticipanti ai moleculei centrale formeaza o legatura de hidrogen cu un atom H al unei molecule H2O. In aceasta structura, oxigenul are numarul de coordinatie 4, iar hidrogenul numarul de coordinatie 2.
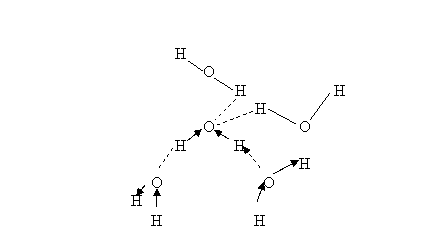 |
Figura 3: O molecula H2O,
din cristalul de gheata, unita prin legaturi de hidrogen de alte
patru molecule H2O, oranduite tetraedric in jurul ei
Continuata la infinit, structura ghetii duce la o retea hexagonala, similara cu a β-tridimitei. Unghiurile de valenta sunt largite la 109,50, iar covalentele HO sunt lungite la 0,99 Ǻ. Distantele O...O sunt de 2,76 Ǻ. Aceasta structura, confirmata si prin difractia neutronilor, explica momentul electric al moleculei H2O, mai mare in gheata decat in apa in stare de vapori.
Structura β-tridimitei ghetii este o structura afanata (la fel ca a wurtzitei si a diamantului). Supusa presiunii, gheata trece in forme cristaline cu retele mai compacte. Gheata obisnuita sau gheata I este in echilibru, la 2050 atm si 220C, cu gheata III, tetragonala, care este in echilibru, la 2100 atm si 34,50 cu gheata II, cubica, ambele cu structuri mai compacte. Se cunosc, in total, sapte forme polimorfe ale ghetii. La gheata VII, forma de temperatura inalta a ghetii, s-a determinat curba de puncte de topire-presiune pana la 4420C si 200.000 atm.
3. Structura apei lichide. Anomaliile proprietatilor fizice ale apei se explica prin faptul ca apa lichida nu este formata din molecule H2O independente, ci din molecule asociate prin legaturi de hidrogen. Desi nu domneste inca unanimitatea de pareri asupra structurilor asociate ale apei, este sigur ca la topirea ghetii nu se rup toate legaturile de hidrogen ale retelei, ci numai o parte din ele. Apa lichida este deci compusa din fragmente cu structura tetraedica, dar si din asociatii cu structuri mai compacte, poate similare cu aceea a cuartului, sau din structuri in forma de colivie. Aparitia, in apa lichida, a unor structuri mai compacte, in echilibru cu structura mai afanata de tridimita, explica cresterea abrupta a densitatii la topire, la 00C, urmata de o crestere mai lenta a densitatii pana la 40C, cand este atins un maxim. Peste aceasta temperatura, densitatea scade monoton. Desi ruperea asociatiilor de molecule de apa, in fragmente mai mici si in molecule simple H2O, continua, are loc si o dilatatie normala ca in orice lichid, datorita cresterii energiei cinetice a moleculelor cu temperatura. Sub 40C predomina primul, peste 40C al doilea dintre aceste efecte antagoniste.
Nu exista polimeri definiti ai apei, ci fiecare molecula de apa tinde sa se inconjoare tetraedic cu alte molecule. In apa lichida se formeaza asociatii de doua pana la sase molecule H2O, care insa exista, individual, numai un timp foarte scurt. Asociatiile de molecule de apa se desfac si se refac necontenit, in asa mod incat numarul total, statistic, de molecule asociate, dintr-o cantitate data de apa, sa ramana constant (la temperatura constanta).
Se apreciaza ca, la topire, se rup brusc 15 % din legaturile de hidrogen din cristalul de gheata; la 400 sunt desfacute aproximativ jumatate din legaturi, iar in stare de vapori sunt desfacute toate legaturile de hidrogen.
Apa ca solvent
1. Apa este cel mai important dintre toti solventii utilizati in tehnica sau aparand in natura. Apa dizolva electroliti (acizi, baze si saruri), formand solutii in care acesti compusi sunt ionizati. De asemenea apa dizolva numeroase substante, atat anorganice cat si organice, care contin atomi capabili de a forma legaturi de hidrogen cu moleculele H2O.
Numeroase reactii au loc in solutie apoasa. Printre acestea au o deosebita insemnatate reactiile biochimice din organismele vii, care la un loc constituie viata.
2. Solvatare. Hidratare. Solubilitatea se datoreste formarii unor legaturi slabe intre moleculele solutului si ale solventului. Fenomenul se numeste solvatare, iar cand solventul este apa, hidratare. Hidratarea se datoreste fie formarii unor legaturi de hidrogen, in cazul substantelor neionizate, fie unor atractii ion dipoli, cand solutul este compus din ioni.
In solutiile compusilor ionici, ionii de semn contrar raman, intr-o mare masura, despartiti (nu formeaza perechi sau asociatii de ioni), in primul rand din cauza constantei dielectrice mari a apei. Acesta nu este insa singurul factor care determina solubilitatea mare a electrolitilor in apa. Unele lichide a caror constanta dielectrica este mai mare decat a apei nu sunt solventi buni pentru electroliti. Solubilitatea in apa a compusilor ionici este determinata de puterea mare a acesteia de a solvata ionii. Fiecare ion se inconjoara de o atmosfera de molecule de apa. Moleculele apei, datorita momentului lor electric (μ = 1,84 D) sunt orientate, in cazul cationilor, cu oxigenul (polul negativ) spre ion, iar in cazul anionilor cu un atom de hidrogen spre ion. In aceste interactiuni solut solvent, se degaja calduri de hidratare considerabile, de acelasi ordin de marime cu energiile de retea.
Un ion se solvateaza cu atat mai puternic (numarul de molecule legate si caldura degajata sunt cu atat mai mari) cu cat volumul ionului este mai mic si sarcina electrica mai mare.
Numarul de molecule de apa, legate de fiecare ion dizolvat, poate fi evaluat cu oarecare aproximatie din experiente de transport al ionilor de electrolize. Urmatoarele date sunt bazate pe masuratori de acest fel:
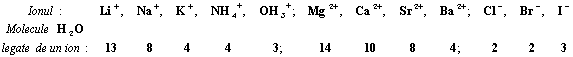
Hidratii
1. Apa de cristalizare. Metoda curenta pentru purificarea substantelor solide consta in cristalizarea dintr-un solvent. Din apa substantele se depun fie anhidre, fie sub forma de cristale continand apa de cristalizare. Asemenea substante se numesc hidrati. Din apa cristalizeaza anhidre relativ putine substante (de ex. unele halogenuri, ca NaCl, NaBr, KI, CsI, substante organice ca zaharoza etc.). Majoritatea electrolitilor si chiar multe substante neionice, anorganice si organice, formeaza hidrati.
Se disting trei mari categorii de hidrati: hidratii electrolitilor (acizi, baze, saruri); hidratii gazelor (stabili de obicei numai sub presiune) si hidratii compusilor formati din ioni de dimensiuni foarte mari (anioni sau amfioni macromoleculari). Hidratii din primele doua clase (singurii de care ne ocupam aici) au compozitie stoechiometrica definita si constanta. Acesti hidrati sunt compusi chimici stabili numai in stare solida. Prin indepartarea apei, reteaua cristalina se naruie; se formeaza substante anhidre a caror retea nu are nici o legatura cu reteaua cristalina a hidratului.
Moleculele de apa de cristalizare fac deci parte integranta din retele cristaline ale hidratilor. Hidratii compusilor macromoleculari (cum sunt unii silicati si proteinele) includ apa in interstitiile retelei lor, care in unele cazuri se dilata, fara a se modifica esential.
2. Hidratii ca substante definite. a. Sulfatul de sodiu cristalizeaza din solutii saturate, la temperaturi mai joase decat 32,3830, cu zece molecule de apa de cristalizare: Na2SO4 10 H2O. Deasupra acestei temperaturi, cristalizeaza Na2SO4 anhidru. La temperatura indicata mai sus, decahidratul, sulfatul anhidru, solutia saturata si vaporii de apa sunt in echilibru. Solubilitatea sulfatului de sodiu creste cu temperatura, fiind maxima, anume 33,2 % (cca. 50 g substanta anh. in 100 g H2O) la 32,3830; ea scade apoi incet cu temperatura. Punctul de solubilitate maxima, intr-o diagrama solubilitate-temperatura, reprezinta o discontinuitate ce delimiteaza domeniul de stabilitate al decahidratului (in stanga) si cel al sulfatului anhidru (in dreapta).
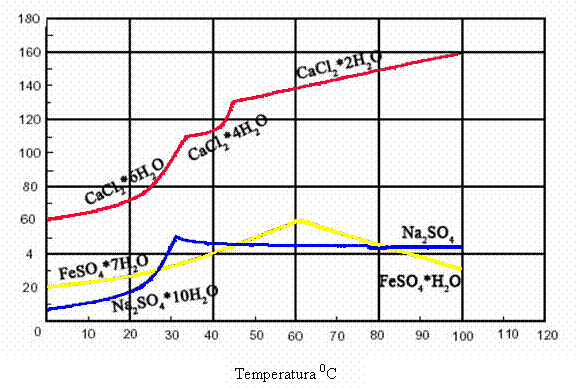
Figura 4: Curbele de solubilitate ale clorurii de calciu, sulfatului de sodiu si sulfatului feros
O comportare similara cu a sulfatului de sodiu prezinta sulfatul feros, cu deosebirea ca faza stabila peste punctul de transformare nu este sulfatul anhidru, ci monohidratul, FeSO4 H2O. Clorura de calciu, CaCl2, formeaza hidrati cu 6, 4, 2, 1 molecula H2O, fiecare din ei fiind stabil intr-un anumit domeniu de temperatura.
b. Presiunea de vapori a hidratilor. Cand o substanta formeaza mai multi hidrati, hidratul cel mai bogat in apa este stabil la temperatura mai joasa. Prin incalzire, acest hidrat pierde apa, trece in altul mai sarac in apa si, in sfarsit in substanta anhidra.
La temperatura constanta, intr-un sistem inchis, fiecare hidrat este in echilibru cu vaporii sai, conform teoriei echilibrelor heterogene, cu alte cuvinte, la temperatura constanta, fiecare hidrat are o presiune de vapori constanta.
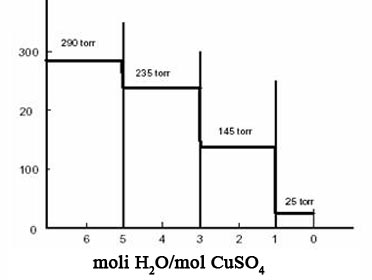
Vom considera cei trei hidrati ai sulfatului de cupru:
CuSO4 5 H2O CuSO4 3 H2O si CuSO4 H2O
Daca intr-un vas inchis, prevazut cu un manometru si mentinut la temperatura constanta, in exemplul ales 780 C, se introduce o solutie saturata de sulfat de cupru, impreuna cu pentahidratul cristalizat, presiunea de vapori masurata este 290 torr. Evacuand din timp in timp, prin pompare, vaporii de apa formati, presiunea se mentine constanta atata timp cat mai exista solutie in vas, apoi ea scade brusc la 235 torr, care este presiunea de vapori (la 780 a pentahidratului). Aceasta presiune se mentine constanta pana ce (in urma evacuarii vaporilor) a disparut intreaga cantitate de pentahidrat. In acest moment presiunea scade brusc la 145 torr, care este presiunea de vapori a trihidratului. Un salt similar se produce la disparitia trihidratului.
Sulfatul de cupru monohidrat, asa cum se obtine la incalzirea slaba a pentahidratului obisnuit, intr-o capsula de portelan pe o flacara, este o pulbere cenusie, aproape alba. Culoarea albastra a pentahidratului este datorita ionului Cu2+, hidratat cu patru molecule de apa. Prin umezirea monohidratului, culoarea albastra apare din nou.
4.
 Higroscopicitate. Delicvescenta.
Eflorescenta. Daca se lasa bucatele de clorura de
calciu anhidra, CaCl2, la aer, ele absorb vapori de apadin
atmosfera, trecand intai in CaCl2
H2O, apoi in CaCl2
2 H2O
si in sfarsit in CaCl2
6
H2O. Substantele care au proprietatea de a
absorbi vapori de apa din atmosfera se numesc higroscopice.
Higroscopicitate. Delicvescenta.
Eflorescenta. Daca se lasa bucatele de clorura de
calciu anhidra, CaCl2, la aer, ele absorb vapori de apadin
atmosfera, trecand intai in CaCl2
H2O, apoi in CaCl2
2 H2O
si in sfarsit in CaCl2
6
H2O. Substantele care au proprietatea de a
absorbi vapori de apa din atmosfera se numesc higroscopice.
Unii hidrati, printre care CaCl2 6 H2O, lasati la aer, continua sa absoarba apa, transformandu-se intr-o solutie concentrata. Asemenea substante sunt delicvescente.
Hidratii bogati in apa, cum sunt Na2SO4 10 H2O si Na2CO3 10 H2O lasati la aer, pierd o parte din apa lor de cristalizare.
Figura 5: Presiuni de vapori ale hidratilor sulfatului de cupru la 780
Totodata cristalul lor se distruge, transformandu-se intr-o pulbere; se produce eflorescenta.
Proprietatea unei substante de a fi delicvescenta sau eflorescenta, la aer, este determinata de trei factori: presiunea vaporilor de apa din atmosfera, presiunea de vapori a hidratului si presiunea de vapori a solutiei saturate. O substanta este delicvescenta cand presiunea de vapori a solutiei saturate este mai mica decat a vaporilor de apa din atmosfera. Hidratul unei substante devine eflorescent cand presiunea lui de vapori este mai mare decat cea a vaporilor de apa din atmosfera. Sa consideram presiunile de vapori, la 200, ale unor hidrati si ale solutiilor lor saturate:

Sa admitem ca in ziua in care experimentam, presiunea partiala a vaporilor de apa din aer (umiditatea absoluta) este 14 torr. In aceasta zi CaCl2 6 H2O si NH4NO3 (care cristalizeaza anhidru) vor fi delicvescente, in timp ce Na2SO4 10 H2O va fi eflorescent. CuSO4 5 H2O va fi insa stabil, fiindca hidratul are o presiune de vapori mai mica, iar solutia saturata are o presiune de vapori mai mare decat presiunea partiala a vaporilor de apa din atmosfera. Intr-o zi geroasa, in care presiunea de vapori din aer este mica, CaCl2 6 H2O si NH4NO3 nu sunt delicvescente; intr-o zi umeda de vara, Na2SO4 10 H2O nu va fi eflorescent.
4. Structura chimica a hidratilor. a. Hidrati si ammine. S-a crezut, la inceputul teoriei electronice, ca hidratii sarurilor sunt complecsi mult asemanatori cu complecsii analogi ai amoniacului, numiti ammine. Amminele se obtin prin actiunea amoniacului gazos asupra sarurilor anhidre sau prin cristalizarea sarurilor anhidre dintr-o solutie apoasa concentrata de amoniac. Amminele sunt, in general, mai stabile decat hidratii. Sunt importante mai ales amminele metalelor tranzitionale.
b. Structura cristalina a hidratilor. Dupa cum a aratat cercetarea cu raze X a hidratilor oxisarurilor, cationul este intotdeauna inconjurat de un numar de atomi de oxigen, corespunzand numarului sau de coordinatie. Acesti atomi de oxigen pot apartine unor molecule de apa sau oxianionilor SO42 , PO43 etc. In acesti hidrati joaca un mare rol legaturile de hidrogen intre moleculele de apa, sau intre acestea si atomii de oxigen ai oxianionilor.
In cristalele de acest fel, moleculele de apa sunt coordinate tetraedric. O molecula de apa este un cuadrupol, avand doi poli pozitivi (atomii H) si doi poli negativi (perechile de electroni neparticipanti). In cristal, moleculele de apa sunt orientate cu polii lor negativi spre cationi si cu polii pozitivi spre anioni sau spre alte molecule H2O.
Ne marginim aici la doua exemple: sulfatul de cupru pentahidrat, CuSO4 ∙ 5 H2O, cu structura tridimensionala infinita si sulfatul de calciu dihidrat sau ghipsul, CaSO4 ∙ 2 H2O, cu structura stratificata. In cristalul de ghips au fost stabilite si pozitiile atomilor H ai legaturilor de hidrogen. Ei se gasesc la distanta 0,98 Ε de un atom O al apei, legatura O─H∙∙∙O fiind liniara.
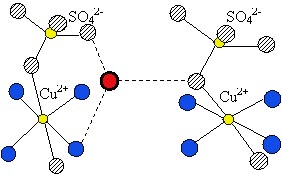
Figura 6: Structura cristalului de CuSO4 ∙ 5 H2O. Atomul de cupru este inconjurat
octaedric de sase atomi O, dintre care patru apartin unor molecule H2O,
iar doi (hasurati) unor ioni SO42 . A cincea molecula H2O (din centrul figurii)
este unita prin patru legaturi de hidrogen, de atomii O ai moleculelor de apa
si ai ionilor de sulfat (atomii de hidrogen nu apar in figura).
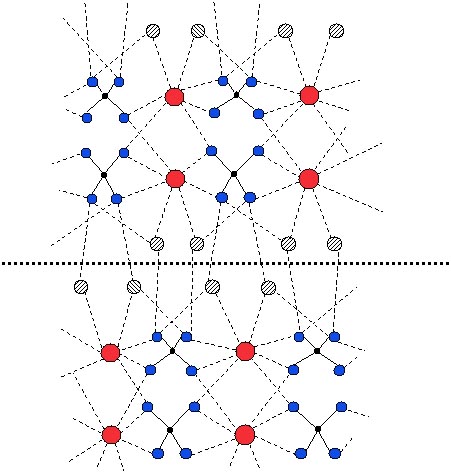
Figura 7: Sectiune printr-un cristal de ghips, CaSO4 ∙ 2 H2O, perpendiculara pe
straturi. Straturile sunt compuse din ionii SO42 (tetraedre) si Ca2+ (cercurile
mari rosii), cu moleculele de apa (cercurile hasurate) inspre exterior.
Linia punctata groasa indica planul de clivaj, care rupe numai legaturi
de hidrogen, O─H∙∙∙O.
c. Hidratii cu structura similara ghetii. In cristalelor hidratilor foarte bogati in apa, cum sunt Na2SO4 ∙ 10 H2O, Na2CO3 ∙ 10 H2O, Na2HPO4 ∙ 12 H2O etc., cationii si anionii sunt distribuiti atat de rar, incat nu vin in contact unii cu altii. Moleculele de apa sunt coordinate tetraedric cu alte molecule de apa, formand un fel de colivii (cluster). Un tip de colivie, dintre cele mai simple, este dodecaedrul pentagonal compus din 20 molecule H2O cu un spatiu interior gol, cu diametrul de 5,2 Ε. Un altul este un poliedru similar cu 14 fete, compuse din 24 molecule H2O si un spatiu interior al coliviei cu diametrul 5,9 Ε. Aceste poliedre pot fi combinate intre ele in diferite moduri (asa incat unele molecule H2O sa faca parte din doua poliedre vecine). Iau astfel nastere constructii tridimensionale complicate, ale caror goluri sunt ocupate de ionii electrolitului, care le stabilizeaza astfel. La o anumita temperatura fixa, corespunzand intru-totul unui punct de topire, reteaua de apa se naruie, adica se topeste si se obtine o solutie suprasaturata de Na2SO4 in apa, din care, dupa scurta vreme, cristalizeaza Na2SO4 anhidru.
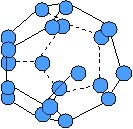
Figura 8: O structura "colivie". Un dodecaedru pentagonal compus din 20 de molecule H2O,
in care fiecare atom de O este coordinat tetraedric (atomii H nu apar in desen).
d. Hidratii gazelor (clatrati). Numeroase gaze, printre care se numara elemente ca gaze rare (Ar, Kr, Xe, Rn), halogeni (Cl2, Br2), hidrocarburi (CH4, C2H6) si alti compusi (H2S, H2Se, PH3, CF4, CH3Cl etc.) formeaza cu apa, la temperaturi joase si uneori numai la presiuni mari, cristale care sunt stabile numai sub o anumita temperatura de descompunere si peste o presiune de descompunere corespunzatoare. La hidratii gazelor rare stabilitatea creste cu masa atomica:
Hidratii de: Ar Kr Xe
Punct de descompunere: 80 130 240C
Presiune de descompunere: 98 15,5 1,3 atm
Metanul formeaza cu apa un hidrat, stabil sub 290 si peste 26 atm, care uneori produce dificultati tehnice astupand conductele de gaz. Clorul formeaza cu 7,66 moli H2O, un hidrat relativ stabil (temp. de descompunere +9,60; presiunea de descompunere 250 torr).
Cristalele majoritatii hidratilor de acest tip sunt construite din colivii poliedrice. Celula elementara cristalografica a celei mai simple dintre acestea este compusa din 46 molecule H2O si contine sase spatii interstitiale mari (5,9Ε) si doua mici (5,2Ε). Daca toate aceste goluri interstitiale sunt ocupate cu molecule straine, M, raportul M:H2O este egal cu 1:5,75, iar moleculele M, considerate singure, formeaza o retea cubica. O asemenea structura se intalneste la hidratii de: Ar, Xe, CH4, C2H6, CO2, SO2, CH3Cl etc. Cand moleculele straine au volum prea mare, ele ocupa numai golurile interstitiale mari si raportul M:H2O = 1:7,67. Acest tip de retea se intalneste la Cl2, Br2 si CH3Br. Moleculele si mai mari (C2H5Cl, CH3I si CHCl3) formeaza un alt tip de retea, compusa din celule elementare de 136 molecule H2O si opt goluri interstitiale mari. La aceasta retea, raportul M:H2O = 1:17.